1998, la naissance de la chimie verte
Le 20ème siècle est le témoin de la croissance exponentielle de la fabrication de biens manufacturés. A l’origine de la transformation de la matière : l'industrie chimique. En plus des problématique de soutenabilité, cette industrie est pointée du doigt pour son impact sur l’environnement et la santé humaine. C’est ainsi qu’est né le paradigme de la chimie verte, c’est-à-dire une chimie durable. Un ensemble de principe permettent à ce secteur de réduire son impact sur l’environnement et d’être en accord avec la santé humaine. Le livre « green chemsitry », publié par Paul Anastas et John Warner en 1998 présente 12 principes pour que la chimie s’aligne avec le principe de durabilité. La chimie verte est un champs de recherche relativement récent.
Romain Chavallard
1/4/202413 min read


1998, pour la chimie, c’est l’aboutissement de plusieurs décennies d’évènements qui conduisent à une prise de conscience et à la naissance de la chimie verte.
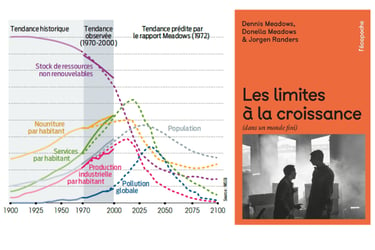
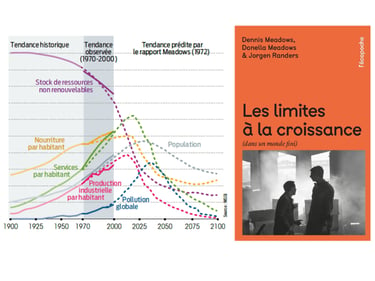
D’un coté, n a une prise de conscience 25 ans avant, Le club de Rome publie le rapport Meadows qui s’appelle « halte à la croissance ». La soutenabilité de la consommation des ressources est pointée du doigt. [i]
La chimie qui est au centre du processus de transformation des matières premières doit s’adapter à ces nouveaux enjeux. En 1997, le protocole de Kyoto vise à réduire les émissions de gaz à effet de serre et parmis les gaz cités, le CO2, dioxyde de carbone, le méthane, le protoxyde d'azote et les chlorofluorocarbones.[ii] Pour cela la chimie doit opérer un tournant pour réponde à ces enjeux.
Les raisons de l’image négative de la chimie
S’il y a bien un secteur qui est une pierre angulaire de la production industrielle, c’est bien l’industrie chimique. La moindre étape de transformation de matière première comme le pétrole, les métaux, la biomasse, le gaz, les minéraux en commodité (solvant, béton, ) ou en produit d’intérêt plus technique (médicament, cosmétique, peinture) dépend de l’industrie chimique. A lui seul, ce secteur représente 9% des émissions mondiales de CO2. Sa transition vers un fonctionnement compatible avec les limites planétaires et avec le respect de l’environnement est en marche depuis une vingtaine d’année.
D’autant plus que la chimie voit son image se ternir par plusieurs catastrophes industrielles majeures. En janvier 1966, une raffinerie de la ville de Feyzin, situé au bord du Rhône, au sud de Lyon, est le siège d’une catastrophe industriel. Une fuite de propane à entrainer une explosion puis un incendie d’ampleur. Cette catastrophe entraina la mort de 18 personnes dont 11 pompiers.
En décembre 1984, la plus grande catastrophe de l’industrie chimique se produit. 40 tonne d’isocyanate de méthyl se répandent dans les quartiers populaire de la ville de Bohpal en Inde. Ce composé est un intermédaire dans la synthèse d’un pesticide : le Sevin (UCC). L’explosion puis la chaleur entraine la formation d’acide cyanidrique et d’autre composé hautement toxique. Le bilan humain s’léevera à 3828 morts.
Plus récemment, la catastrophe de l’usine AZF de Toulouse en 2001, où l’explosion de nitrate d’ammonium à entrainer le décès de 31 personnes. Ou encore l’explosion de l’usine de Lubrizol en 2019 ou des dépôts de produits phosphoré et soufrés ont brulés et formé un épais nuage de fumée dont les conséquences à long terme ne sont toujours pas évaluées, et en fin l’explosion dramatique du port de Beyrouth en 2020 de stock de nitrate d’ammonium qui a entrainé le mort de 215 personnes.
C’est avec ces catastrophe que nous prenons conscience de la dangerosité de cette industrie. Des principes comme la réduction des déchets, le design de molécules moins dangereuse ou l’utilisation de ressources renouvelable peuvent permettent de réduire l’impact de l’industrie chimique sur la santé humaine et sur l’environnement.
L’émergence et la théorisation de la chimie verte
Face à cette nécessité de faire opérer à la chimie un virage pour répondre à enjeux environnementaux, une nouvelle branche de la chimie nait, une chimie écocompatible, elle s’appellera la chimie verte. La théorisation de cette chimie va se faire à travers le livre « green chemistry » de Paul Anastas et de John Warner.
Paul T. Anastas, Américain né en 1962, est professeur en chimie pour l’environnement et directeur du centre de recherche en chimie verte à l’université de Yale.[i] Chimiste organicien de formation, il obtient son doctorat en 1991 à l’université de Brandeis (Boston). Très vite, ses recherches se sont orientées vers l’environnement pour aboutir à l’écriture du livre « green chemistry » (chimie verte en anglais) avec son ami John Warner, également chimiste. On constate clairement l’évolution au cours de sa carrière l’évolution du thème de ses recherches. Initialement sur les hétérocycles (furan, imidazole entre les années 80-90), il s’oriente vers les synthèses alternatives, plus éco-compatible. La théorisation des principes de la chimie verte se fait pendant la période 95-2000. Chaque congrès, symposium, revue à comité de lecture ou article est un bon vecteur pour diffuser ces principes. Après les années 2000, Anastas reprend la recherche, notamment en travaillant sur la catalyse[ii], les réactions tandem à fort économie d’atome[iii], sur les solvant alternatifs[iv] et plus récemment sur la valorisation de la bioamasse.[v]
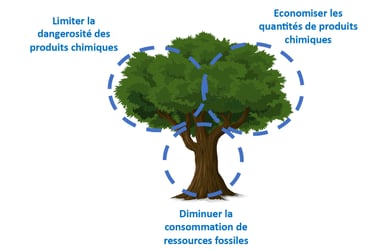
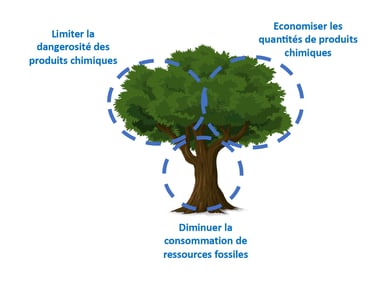
Les 12 principes de la chimie verte à travers 3 axes
Le livre Chimie Verte s’articule autour de 12 principes[vi] que doit suivre la chimie pour devenir durable. C’est à partir de ces piliers du développement durable que ce sont dessinés les 3 grands axes de la chimie verte.
- Dangerosité des produits chimique
- Sources de produits chimique renouvelable
- L’Économie de matière
Le premier émerge des différents accidents industriels au cours du dernier siècle. Les rejets peu contrôlés dans la nature ont conduit à donner à juste titre une image peu éco-compatible de la chimie. 6 principes sont ainsi dédiés à la réduction de la dangerosité des produits chimique.
Le second axe consiste à réduire la quantité de déchet. Du point de vue de la nature, le déchet n’existe pas. Du point de vue homo œconomicus, le déchet est un passif. Le but de cet axe et de ces 5 principes est de placer le déchet au centre du développement, soit en le valorisant ou en évitant sa génération.
Enfin, le dernier axe consiste à réduire l’utilisation de ressources fossiles et de favoriser les ressources d’origines renouvelables.
Dans les travaux d’Anastas et de Warner, l’idée de l’arbre de la chimie verte (green chemistree en anglais) permet de représenter ces principes. Ils sont tous intrinsèquement liés et interagissent entre eux lors de la recherche de réactions chimique écocompatibles.
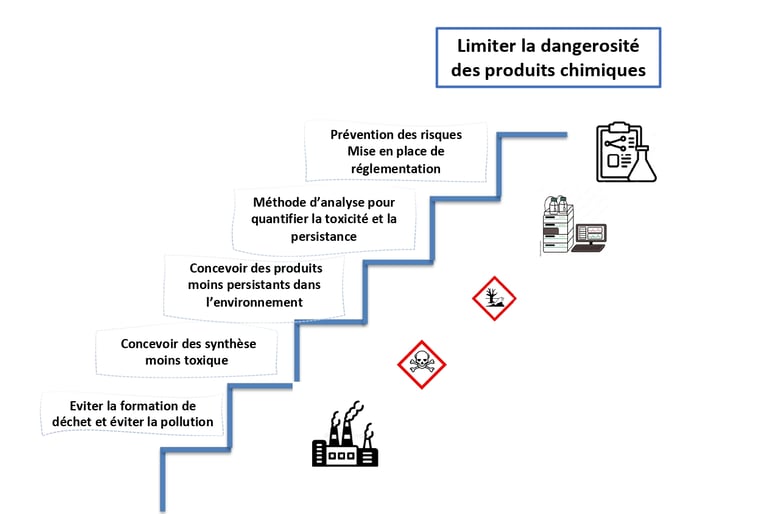
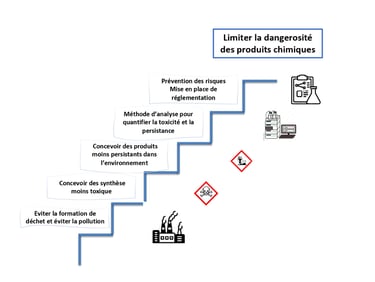
Axe 1 - limiter la dangerosité des produits chimiques
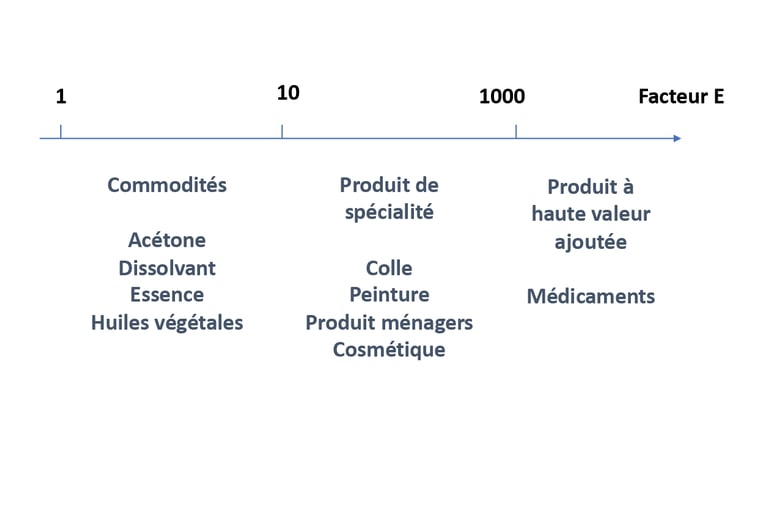
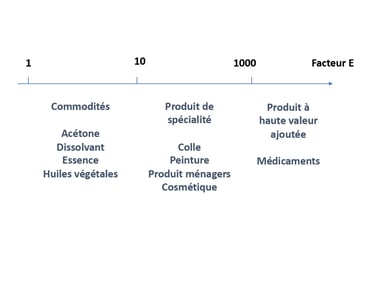
Le premier axe de la chimie verte peut se schématiser comme un processus menant à limiter la dangerosité des produits chimique. Chacune des marches du processus est essentiel pour arriver cet objectif. La première étape, la plus évidente, est de limiter la pollution. La source de pollution de l’industrie chimique sont les déchets et rejets. La part en produit fabriqué représente dans certaine industrie une faible quantité par rapport à celle des déchets générés. Le facteur E représente ce rapport. Les produits chimiques de commodité génèrent environ 5 kg de déchets pour 1 kg de produit fini, soit un facteur de E de 5. A l’inverse, les produits pharmaceutiques présentent un facteur E pouvant aller jusqu’à 1000. Les multi-étapes, les co-réactif en excès ou les solvant de purification sont quelques exemples des déchets générés. Certains sont difficilement valorisable car le coût de régénération est généralement plus élevé que celui de destruction.
La nature de ces déchets conditionne l’appellation « pollution ». Si ces rejets sont sans danger pour la santé humaine ou sans impact sur l’environnement, alors ils ne seront pas considérés comme polluant. Mais ce n’est évidemment rarement le cas. C’est pourquoi les chimistes travaillent au développement de synthèse moins toxiques. C’est-à-dire que la toxicité des réactifs et des produits fabriqués est prise en considération lors du développement d’un procédé de fabrication. Cela paraît évident aujourd’hui, mais ne l’a pas toujours été. Encore maintenant, certains laboratoires de recherche axe leurs travaille uniquement en prenant considération l’aspect économique, c’est-à-dire le rendement de la réaction, sans tenir compte de l’impact des déchets générés ou de la toxicité des molécules produites. Le même idée est exprimé par la marche suivante : la persistance des produits chimique. Beaucoup d’exemple de l’industrie chimique symbolise les effets à long terme l’incapacité de la nature à dégrader certaines molécules. Le site de Bophal en Inde est toujours contaminé.[vii]
Un dernier exemple dramatique sur notre sol montrant la persistance des produits chimique sont la pollutions et terres et des nappes ayant été bombardés durant la 1ere guerre mondiale. Plus d’un siècle après la dernière bombe larguée dans les sols de la région de Verdun sont toujours pollué d’Arsenic, un composé hautement toxique.[viii]
Ce sont grâce à de nouvelle méthode d’analyse qu’il est possible de monitorer, quantifier et contrôler les rejets polluants. Ces dernières doivent constamment s’adapter au nouveau type de produits chimique développés. Des domaines comme la toxicologie permettent désormais d’appréhender et de prévoir l’impact sur la santé humaine des produits chimique. Même si la prise de conscience de l’effet néfaste de certains aspects de l’industrie chimique sur l’environnement, certains industriels privilégient encore l’aspect économique, à celui de l’écologie. Le législateur doit intervenir pour mettre des contraintes réglementaires aux industriels afin de protéger les populations et l’environnement. Ces règlementations et restrictions peuvent être impulsées par des collectifs non-gouvernementaux ou directement par des agences nationales de protection des populations ou de l’environnement. Le but, in fine est de limiter la dangerosité des produits chimique et d’en protéger la santé humaine et son environnement.
Axe 2 - Economiser la quantité de produit chimique
Le 20ème siècle VS le 21ème
Dans l’autre siècle, le sacro-saint indicateur d’une réaction chimique, c’était le rendement.
Dans une réaction chimique, si je fais réagir 1 équivalent d’un réactif avec 100 équivalents d’un autre réactif B et que j’obtiens 1 équivalent de mon produit C, alors mon rendement =>
(1/1)x100 = … 100%
Oui… c’était ça l’indicateur phare de la chimie
Mais avec un œil plus… environnementaliste, on se rend compte des 99 équivalents de déchets générés issus du réactif B.
Si le ratio entre la quantité de déchets générée et la quantité de produit C fabriqué est réalisé, alors nous avons :
(98/1) x 100 = 98…
C’est le facteur E, aussi appelé le Facteur de Sheldon.
Plus il est élevé, plus la réaction génère de déchets.
Généralement calculé en kilo, on se rend compte que les produits pharmaceutiques peuvent générer 1 tonne de déchets, pour seulement 1 kg de produit fini.
In fine, la stratégie de fabrication de ces molécules doit être un compromis entre respect environnemental et coûts financiers.
La chimie est une science large, pourtant depuis le début du millénaire, une branche semble avoir pris le dessus sur les autres : la catalyse.
Les années 2001, 2005, 2010 et 2021, prouvent l’intérêt ces dernières années pour cette branche de la chimie.
C’est presque 20% des prix nobels de chimie depuis 2000 !
Un catalyseur, c’est un composé utilisé en très faible quantité (1% ou moins), qui accélère la réaction, qui est restitué de manière intacte en fin d’utilisation, régénérable et réutilisable pour une prochaine réaction.
Un exemple de rupture et d’innovation sont les travaux de Grubbs de 2005. Le développement d'un catalyseur de métathèse permet, par une approche révolutionnaire, la formation de composés insaturés.
Plus récemment, c’est l’approche par la biocatalyse. Les catalyseurs sont des enzymes naturelles ou modifiées. Les conditions de réactions sont douces (température ambiante dans l’eau). Les enzymes (comme celle du corps humain) ont des capacités remarquables, loin devant les meilleurs chimistes.
Prenons un exemple simple de la vie courante. Lors d’un état de stress, les glandes surrénales sécrètent de l’adrénaline à partir de la noradrénaline via l’enzyme N-methyltransférase. Comme son nom l’indique cette enzyme transfert un groupe méthyl sur l’amine de l’adrénaline.
Si un chimiste devait synthétiser de l’adrénaline, il utiliserait le chlorure de chloroacétyl, qui est hautement toxique. La biomimétique semble être inspirante pour le développement nouveaux catalyseurs. C’est l’approche de Gunter Pauli et l’économie bleue.
Axe 3 - La chimie à partir de ressources renouvelable
D’origine végétale ? Une mention qu’on entend souvent
En fait, cela fait référence à la source dont est issu l’atome de Carbone contenu dans les molécules.
Carbone mort ou Carbone vivant
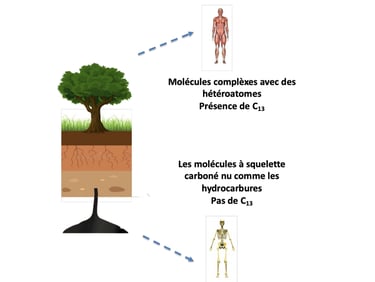
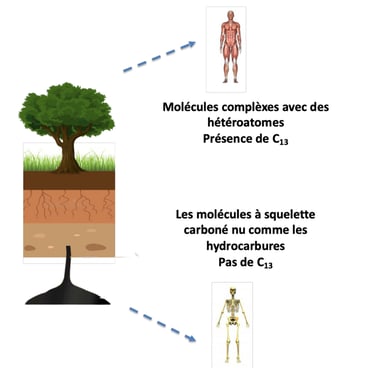
Le carbone mort est issu de ressources fossiles (pétrole, charbon). Son isotope stable le C14 est entièrement dégradé et les molécules présentes sont dites pauvres en hétéroatomes (oxygène, azote)
Ce sont des squelettes carbonés, uniquement composés de Carbon et de l’Hydrogène.
A l’inverse, le Carbone vivant est généré par les organismes végétaux. Ils utilisent le dioxyde de carbone de l’atmosphère, ce qui assure un renouvellement en C14.
La différence entre une molécule d’origine végétale et d’origine fossile, c’est en fait la présence de C14.
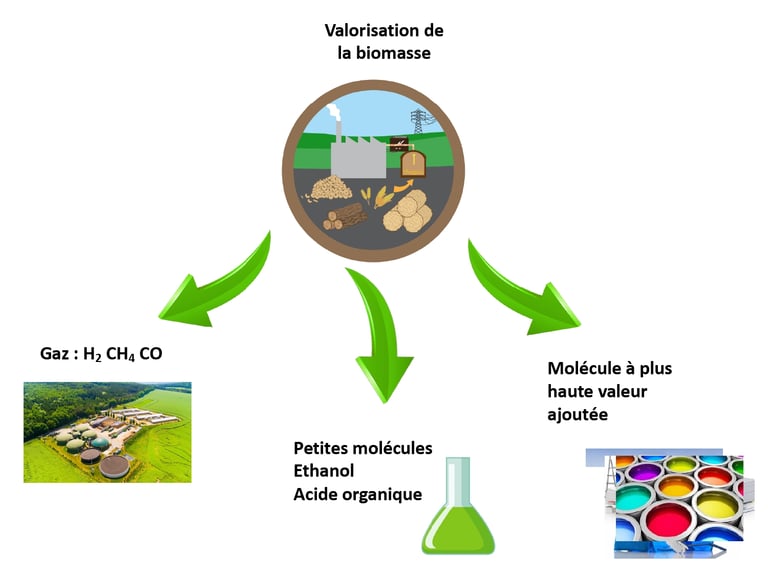
La chimie du végétal donne un accès quasi-direct à un nouvel éventail de molécules qui représentai jusqu’à présent un faible intérêt. Autrefois, nous pouvons dire, avant le 18ème siecle, le végétal était le seul pourvoyeur de molécule. Après la découverte du pétrole, il est devenu marginal. Les filières végétales pour la chimie connaissent un regain d’intérêt depuis le début du 21ème siècle, grâce notamment au biocarburant, et encore plus ces dernière années avec son élargissement aux autres secteurs de la chimie.
2 approches sont viables pour relier un usage à une filière végétale, l’approche ascendante, c’est-à-dire qu’une molécule végétale brute est utilisable pour une application précise en remplaçant un composé pétrosourcé, soit via une approche déscandate, où une molécue cible est synthétisé à partir d’une molécule de base issus du monde végétal.
Approchons nous et regardons les grandes familles végétales utilisés dans les filières de l’agrochimie ainsi que les molécules qui en sont extraites. Nous pouvons trier les familles de molécules végétales :
Sucre (Oses et Oligosaccharide)
Amidon
Lipide
Protéine
Lignine
Les oses et oligosaccharides sont majoritairement présents dans la betterave (75% M racine), canne à sucre (50% M tige). Les sucres sont très faciles à extraire. Les sucres sont également présents dans les céréales ou légumineux mais en quantité marginale (<5%M).
L’amidon est un polysaccharide. Contrairement aux sucres précédents, la taille de la molécule est bien plus élevée (oses < oligosaccharide < polysaccharide). C’est la forme la plus rependue dans les plantes supérieures. L’amidon peut représenter jusqu’à 80%M de la plantes (céréales, tubercule).
Les sucres cours peuvent servir comme molécules de base. A l’inverse, les polysaccharides peuvent être déconstruits en molécules plus simples ou alors utilisés tel quel pour des applications d’épaississant ou gélifiant.
Les lipides. Les huiles sont accumulées dans les oléosomes des graines sous forme de triglycérides. Ces derniers sont des esters de glycerol et d’acides gras. Les graines et fruits les plus connus contenant ces triglycérides sont le colza, tournesol, soja, palmier, cocotier, olivier.
Cette filière est un excellent pourvoyeur d’acide gras. De même, ces acides gras, s’ils comportent des fonctions chimiques réactives (diol, hydroxy, époxyde, insaturation), alors ils peuvent être valorisés en d’autres molécules grâce à la chimie de synthèse qui va venir s’appuyer sur ces fonctions pour la réalisation de réactions de coupures. A l’inverse les acide gras dit saturés, ne comportant que la fonction acide carboxylique en bout de chaine présentent des débouchés plus restreints. Ils peuvent être utilisés dans la filière des tensioactifs grace à la différence d’hyrophilie présente au sein de la structure ou comme substituant à l’huile de synthèse après réduction de la fonction acide.[xi][x]
[i] R. Meyran, Alternatives Economiques, 01 février 2019
[ii] Kyoto protocol reference manual, on accounting of emission and assigned amount, UNFCC
[i] https://seas.yale.edu/faculty-research/faculty-directory/paul-anastas
[ii] - Anastas, Paul T.; Kirchhoff, Mary M.; Williamson, Tracy C. Applied Catalysis, A: General (2001), 221(1-2), 3-13
Anastas, Paul T.; Williamson, Tracy C. Green Chemistry (1998), 286-311 |
[iii] Eghbali, Nicolas; Eddy, Jennifer; Anastas, Paul T. Journal of Organic Chemistry (2008), 73(17), 6932-6935
Anastas, Paul T.; Williamson, Tracy C.Green Chemistry (1998), 166-177
[iv] Anastas, Paul T.ACS Symposium Series (2002), 819, 1-9
[v] Barta, Katalin; Warner, Genoa R.; Beach, Evan S.; Anastas, Paul T. Green Chemistry (2014), 16(1), 191-196
Warner, Genoa; Hansen, Thomas S.; Riisager, Anders; Beach, Evan S.; Barta, Katalin; Anastas, Paul T.
Bioresource Technology (2014), 161, 78-83
[vi] J.Augé et M. C. Schermann, Chimie verte - Concepts et applications, 2016, p 13 - 21
[vii] https://www.novethic.fr/lexique/detail/bhopal.html
[viii] B. Hopquin, Le monde, 2014, Le poison de la guerre coule toujours à Verdun
L’ancienne ligne de front souffrira longtemps des conséquences écologiques du conflit.
[xi] Gallezot, P., 2012. Critical review: Conversion of biomass to selected chemical products, Chemical Society Reviews, 41, 1538-1558.
[x] Gallezot, P., 2007. Process option for converting renewable feedstocks to bioproducts, Green Chemistry, 9, 295-302.